Рак полового члена
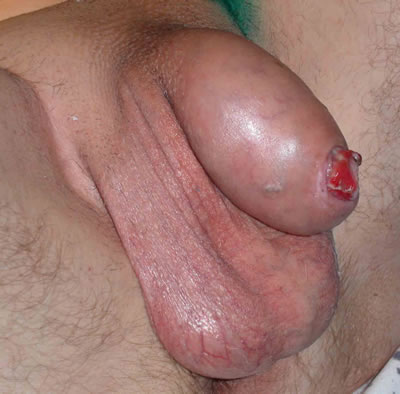
Внешний вид полового члена - рак полового члена
Опухоли полового члена могут быть доброкачественными и злокачественными. Они также подразделяются на эпителиальные и неэпителиальные, У детей опухоли полового.члена чрезвычайно редки и носят в большинстве случаев доброкачественный характер.
Наиболее распространены доброкачественные эпителиальные опухоли. Рак полового члена встречается, как правило, у мужчин с необрезанной крайней плотью.
Рак полового члена составляет 1-2%
всех опухолей мочеполовой системы в России; уровень заболеваемости в
странах Европы и Северной Америки составляет 0,4-0,9 случаев на 100000
мужчин в год. Однако заболеваемость в некоторых странах Азии, Африки и
Южной Америки достигает 20% среди всех онкологических заболеваний у
мужчин и 45% среди опухолей мочеполовой системы.
Рак полового члена чаще обнаруживается у пожилых
мужчин 50-70 лет, но до 22% больных этим недугом составляют люди до 40
лет. Среди злокачественных опухолей полового члена 95% случаев
приходится на плоскоклеточный рак, остальные 5% - на саркому, меланому и
метастатические опухоли.
Этиология рака полового члена до
конца не изучена.
Однако выявлена четкая взаимосвязь между уровнем
заболеваемости раком полового члена и гигиеническими навыками и
культурными обычаями населения.
Например, в Израиле, где младенцам обычно проводят
обрезание, рак полового члена встречается крайне редко. Если обрезанию
подвергаются подростки, его "защитный" эффект исчезает. Так уровень
заболеваемости раком полового члена среди мусульман выше, чем у евреев.
По всей видимости протективный эффект обрезания
связан с предотвращением накопления смегмы в препуциальном мешке,
образующейся при слущивании эпителия.
В эксперименте нанесение смегмы на шейку матки мышей
индуцировало плоскоклеточный рак шейки матки. Видимо, Mycobacterium
smegmatis разлагает стеролы смегмы до канцерогенных веществ, которые до
сих пор не идентифицированы.
Еще одним виновником развития рака полового члена
считается вирус папилломы человека (HPV). HPV типа 16 и 18 были выявлены
в 70% случаев инвазивного рака полового члена. Механизм канцерогенного
действия вирусов данной группы связывают с вирусными протеинами Е6 и Е7,
которые активно синтезируются в пораженных клетках. Эти белки приводят к
инактивации опухолевых генов-супрессоров р53 и рRb, индуцируя
неконтролируемую пролиферацию клеток.
Не обнаружено связи между перенесенными травмами,
венерическими заболеваниями, воздействием химических канцерогенов и
риском заболеваемости раком полового члена.
Предраковыми заболеваниями при раке
полового члена являются эритроплазия Кейра и болезнь Боуэна.
Эритроплазия Кейра проявляется появлением на головке
полового члена безболезненной хорошо отграниченной, немного приподнятой
гиперемированной бляшки.
При болезни Боуэна на теле полового члена появляется
безболезненное пятно, покрытое чешуйками.
Иногда эритроплазия Кейра и болезнь Боуэна являются
клиническим проявлением carcinoma in situ и в 10% прогрессируют в
инвазивный рак.
Клиническая картина рака полового члена
Практически все болезненные состояния головки полового члена и крайней плоти можно рассматривать как имеющие отношение к возникновению клинической картины опухоли полового члена. На ранних этапах заболевания клинические проявления не выражены, особенно в случае фимоза, когда процесс развивается под узкой крайней плотью. Опухоль полового члена может выглядеть как очаговое покраснение или бугорок, уплотнение, сосочковый вырост или язва. Рак полового члена развивается наиболее часто в области венечной бороздки. При фимозе обращают на себя внимание обильные выделения, иногда кровянистые, характерный запах, сопутствующий деструктивному процессу. Боль не является характерной. При метастазировании могут выявляться увеличенные лимфатические узлы, позже присоединяются вторичные местные и общие проявления заболевания.
Рак полового члена проявляется в виде очага от
грибовидной, экзофитной бляшки до уплотненной язвы. Рак полового члена в
48% случаев развивается на головке, в 21% на крайней плоти,
одновременно на головке и крайней плоти в 9%, на венечной борозде в 6%
случаев и на теле полового члена в 2%. Плоскоклеточный рак полового
члена может поражать подлежащие структуры - кавернозные тела, уретру.
Микроскопически плоскоклеточный рак полового члена
выглядит, как и плоскоклеточные карциномы других локализаций.
Морфологи
различают различные виды плоскоклеточных раков полового члена:
- Бородавчатый рак составляет от 5% до 16% всех новообразований
полового члена. Клинически бородавчатый рак выглядит как грибовидная
масса, поднимающаяся над венечной бороздой. Бородавчатый рак чаще имеет
локальный рост и очень низкий метастатический потенциал, однако часто
рецидивирует после локального иссечения. Важно отметить, что лучевая
терапия противопоказана при бородавчатом раке полового члена, так как
способствует прогрессии заболевания.
- Базальноклеточный рак - недавно описанный вариант плоскоклеточного
рака полового члена. Имеет более агрессивное течение, по сравнению с
бородавчатым раком, быстрее метастазирует в лимфатические узлы и чаще
рецидивирует после проведенного лечения.
- Веретеноклеточный рак полового члена встречается очень редко.
Проявляется разрастанием полиповидных масс на головке полового члена.
Чаще имеет благоприятное течение.
- Меланома составляет менее 1% злокачественных новообразований
полового члена. Меланома чаще располагается на головке пениса.
Определяющим фактором прогноза, как и при меланомах других локализаций,
является глубина инвазии.
Выделяют высоко, умерено, низкодифференцированные и
недифференцированные опухоли полового члена. Морфологическая
дифференцировка опухолей важна для предварительного стадирования и
отдаленного прогноза. Показано, что низко и умеренно дифференцированные
опухоли к моменту установки диагноза имеют метастазы в лимфатические
узлы. При высоко дифференцированных опухолях поражение лимфоузлов
обнаруживается в 50% случаев.
Для стадирования рака полового члена общепринятой
считается классификация TNM (по American Joint
Committee on Cancer 1997)
Т - первичная опухоль
ТХ - недостаточно данных для
оценки первичной опухоли.
Т0 - первичная опухоль не определяется.
TIS
- преинвазивная карцинома (carcinoma in situ).
Та - неинвазивная
бородавчатая карцинома
Т1 - опухоль распространяется на
субэпителиальную соединительную ткань.
Т2 - опухоль распространяется
на губчатое или пещеристое тело.
Т3 - опухоль распространяется на
уретру или простату.
Т4 - опухоль распространяется на соседние
структуры.
N - регионарные лимфатические узлы.
NХ - недостаточно
данных для оценки состояния регионарных лимфоузлов.
N0 - нет
признаков поражения метастазами регионарных лимфоузлов.
N1 -
метастазы в одном поверхностном паховом лимфоузле.
N2 - метастазы в
нескольких поверхностных паховых лимфоузлах или метастазы с обеих
сторон.
N3 - метастазы в глубоких паховых лимфоузлах или в лимфоузлах
(е) таза с одной или с обеих сторон.
М - отдаленные метастазы.
МХ
- недостаточно данных для оценки наличия отдаленных метастазов.
М0 -
отдаленных метастазов нет.
М1 - метастазы в отдаленные органы.
Стадии заболевания
Стадия 0
Tis
Ta
N0
N0
M0
M0
Стадия I
Т1
N0
M0
Стадия II
T1
T2
N1
N0, N1
M0
M0
Стадия III
T1
T2
T3
N2
N2
N0, N1, N2
M0
M0
M0
Стадия IV
T4
T любая
T любая
N любая
N3
N любая
M0
M0
M1
Для рака полового члена характерно лимфогенное
метастазирование в паховые и подвздошные лимфатические узлы.
Гематогенные метастазы появляются на поздних этапах течения заболевания и
могут локализоваться в легких, печени, костях, головном мозге и сердце.
Диагностика и дифференциальная диагностика рака полового члена
Рак полового члена следует дифференцировать с
доброкачественными опухолями (липомами, миомами, ангиомами, папилломами и
др.) и другими кожными заболеваниями (аллергическими реакциями и
инфекционными заболеваниями - сифилисом, герпесвирусной инфекцией и
др.).
В диагностике рака полового члена самыми важными
являются точная оценка распространенности первичной опухоли на
подлежащие структуры и выявление скрытых метастазов в лимфатические
узлы.
При осмотре пациента следует оценить локализацию,
размер, смещаемость первичной опухоли.
По данным S. Horenblas важную роль в оценке глубины
инвазии первичной опухоли играет ультразвуковое исследование. Для более
точной дифференцировки опухоли и соседних структур в уретру
устанавливается катетер малого диаметра.
С помощью ультразвукового исследования можно с
высокой точностью определить инвазию опухоли в белочную оболочку и в
кавернозные тела. В большинстве случаев можно точно определить
расстояние между опухолью и уретрой. Однако очень сложно оценить инвазию
в спонгиозную ткань головки полового члена.
Для оценки глубины инвазии первичной опухоли можно
также использовать МРТ. Однако по предварительным данным никакой
дополнительной информации по сравнению с УЗИ при МРТ получить нельзя.
Окончательный диагноз рака полового члена
выставляется после биопсии видимого образования.
При локализации опухоли на крайней плоти выполняют
циркумцизио. Обрезание в этом случае носит и диагностический, и лечебный
характер. Когда опухолью затронуты головка, крайняя плоть и головка,
венечная борозда или тело, следует выполнять эксцизионную биопсию, в
ходе которой необходимо взять для исследования и подлежащие ткани для
точной оценки глубины опухолевой инвазии.
Если обнаружена carcinoma in situ с негативным
хирургическим краем, за пациентом наблюдают для своевременного выявления
местного рецидива.
Если обнаружена инвазивная опухоль (Т1, Т2 или Т3)
первичная опухоль должна быть резецирована в пределах здоровых тканей,
отступя на 2 см от края опухоли. В зависимости от расположения опухоли
это достигается выполнением циркумцизии, парциальной или тотальной
пенэктомии.
Если обнаруживаются увеличенные паховые лимфатические
узлы, выполняют компьютерную томографию органов брюшной полости.
Лечение первичной опухоли
При наличии carcinoma in situ хорошие клинические
результаты достигаются применением лазерной абляции и лучевой терапии.
Часто лучевая терапия применяется у пациентов,
которые отказываются от хирургического лечения. Возможно применение, как
наружной лучевой терапии, так и брахитерапии. Эффективность лучевой
терапии достигает 80% при опухолях Т1 и Т2. При опухолях Т3 в 70%
случаев после лучевой терапии возникает рецидив.
Поэтому до сих пор "золотым стандартом" лечения
инвазивного рака полового члена является парциальная или тотальная
пенэктомия.
Целью хирургического лечения инвазивной первичной
опухоли является ее радикальное удаление с максимально возможным
сохранением ткани полового члена для нормального мочеиспускания и
половой функции.
Парциальная пенэктомия выполняется при инвазивном
раке дистальной части полового члена.
Тотальная пенэктомия выполняется при проксимально
расположенных опухолях Т3, Т4 с поражением лимфатических узлов.
Хирургическое лечение при вовлечении в процесс лимфатических узлов
К моменту диагностики 58% пациентов с раком полового
члена имеют лимфаденопатию (из них 45% обусловлены метастазами в
лимфатических узлах, остальные - вызваны воспалительной реакцией). Если у
пациента имеется лимфаденопатия, требуется лимфаденэктомия. Причем
из-за широко развитых лимфатических анастомозов у основания полового
члена, часто происходит двухстороннее поражение лимфоузлов, что диктует
необходимость двухсторонней лимфаденэктомии.
Лечебная тактика при отсутствии макроскопических
изменений в лимфатических узлах неоднозначна. Однако в ряде исследований
было продемонстрировано значительное преимущество профилактической
лимфаденэтомии по сравнению с отсроченной. Так в исследовании McDougal
уровень 5-летней выживаемости пациентов, подвергшихся профилактической
лимфаденэктомии составил 88%, а при отсроченной лечебной лимфаденэктомии
- только 38%. Раннее удаление регионарных микрометастазов обеспечивает
среднюю продолжительность жизни, аналогичную таковой в группе пациентов
со стадией N0. Большинство исследователей отмечает высокую
прогностическую значимость стадии Т и степени анаплазии первичной
опухоли для лимфогенной диссеминации рака полового члена. Так, по данным
Ficarra V. (2002), частота поражения лимфоузлов при стадии Т1
составляет 5%-11%, Т2-3 - 60%-75%. Согласно результатам, опубликованным
тем же автором, лимфогенное метастазирование при G1 отмечается в 4%-24%,
G2 - 46%-79%, G3 - 82%-100% наблюдений. Складывается впечатление, что
сочетание стадии Т и степени анаплазии может позволить достаточно точно
предсказать наличие поражения лимфатических узлов. Solsona с соавт.
предлагает разделять больных раком полового члена на группы низкого
(T1G1), умеренного (T1G2-3, T2G1) и высокого (T2-3G2-3) риска. Частота
наличия метастазов в регионарных лимфоузлах в данных группах составляет
0%, 33% и 83% соответственно (Ficarra, 2002) год. На основании
полученных результатов автор делает вывод об однозначной необходимости
удаления регионарных лимфоузлов больным с высоким риском лимфогенного
метастазирования и отказе от операции в группе низкого риска. Вопрос о
показаниях к выполнению паховой лимфаденэктомии остается открытым для
группы умеренного риска, в которой 67% пациентов не нуждается в
хирургическом вмешательстве данного объема.
Химиотерапия используется в лечении неоперабельных
местных рецидивов и метастатического рака полового члена.
Применение комбинированной химиотерапии
циклофосфамидом, блеомицином или цисплатином обеспечивает частичный
ответ у 30% пациентов, но полные ремиссии крайне редки.
Профилактика возникновения вирусных остроконечных кондилом полового члена, передаваемых половым путем при случайных связях, заключается в использовании презервативов и моногамных сексуальных отношений.
Предотвращение рака полового члена в первую очередь состоит в соблюдении гигиены — удалении смегмы из препуциального мешка. Для этого необходимо регулярное его промывание. Соблюдение этого правила должно выполняться с детского возраста.
Отдаленные результаты и прогноз
Отдаленные результаты зависят от глубины инвазии
опухоли, вовлеченности лимфатических узлов, наличия отдаленных
метастазов.
Так, уровень опухолеспецифической выживаемости при Т1
составляет около 94%, при Т2 - 59%, при Т3 - 54%. При N0 - 93%, N1 -
57%, N2 - 50%, N3 - 17% (Schoeneich G., Perabo FGE, Muller SC. 1999).
Учитывая крайне неблагоприятный прогноз и низкое
качество жизни при поздних стадиях заболевания, усилия врачей должны
быть сконцентрированы на раннем выявлении и лечении рака полового члена.
При опухолях полового члена прогноз может считаться вполне благоприятным. При комбинированном лечении 5-летняя выживаемость достигает 60–70% больных, при поздних стадиях она значительно ниже.
Наиболее распространены доброкачественные эпителиальные опухоли. Рак полового члена встречается, как правило, у мужчин с необрезанной крайней плотью.
ТХ - недостаточно данных для оценки первичной опухоли.
Т0 - первичная опухоль не определяется.
TIS - преинвазивная карцинома (carcinoma in situ).
Та - неинвазивная бородавчатая карцинома
Т1 - опухоль распространяется на субэпителиальную соединительную ткань.
Т2 - опухоль распространяется на губчатое или пещеристое тело.
Т3 - опухоль распространяется на уретру или простату.
Т4 - опухоль распространяется на соседние структуры.
N - регионарные лимфатические узлы.
NХ - недостаточно данных для оценки состояния регионарных лимфоузлов.
N0 - нет признаков поражения метастазами регионарных лимфоузлов.
N1 - метастазы в одном поверхностном паховом лимфоузле.
N2 - метастазы в нескольких поверхностных паховых лимфоузлах или метастазы с обеих сторон.
N3 - метастазы в глубоких паховых лимфоузлах или в лимфоузлах (е) таза с одной или с обеих сторон.
М - отдаленные метастазы.
МХ - недостаточно данных для оценки наличия отдаленных метастазов.
М0 - отдаленных метастазов нет.
М1 - метастазы в отдаленные органы.
Ta
N0
M0
T2
N0, N1
M0
T2
T3
N2
N0, N1, N2
M0
M0
T любая
T любая
N3
N любая
M0
M1
Отдаленные результаты и прогноз
Форма входа |
|---|
Статистика |
|---|

